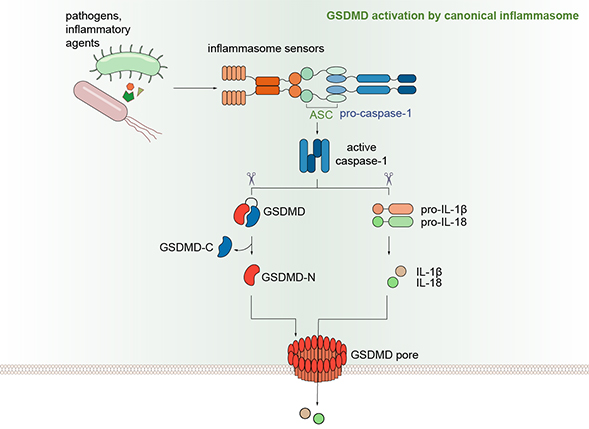
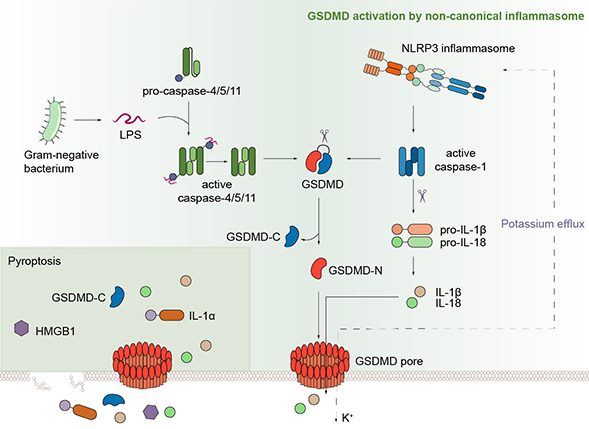
炎症小体和细胞焦亡(pyroptosis)通路
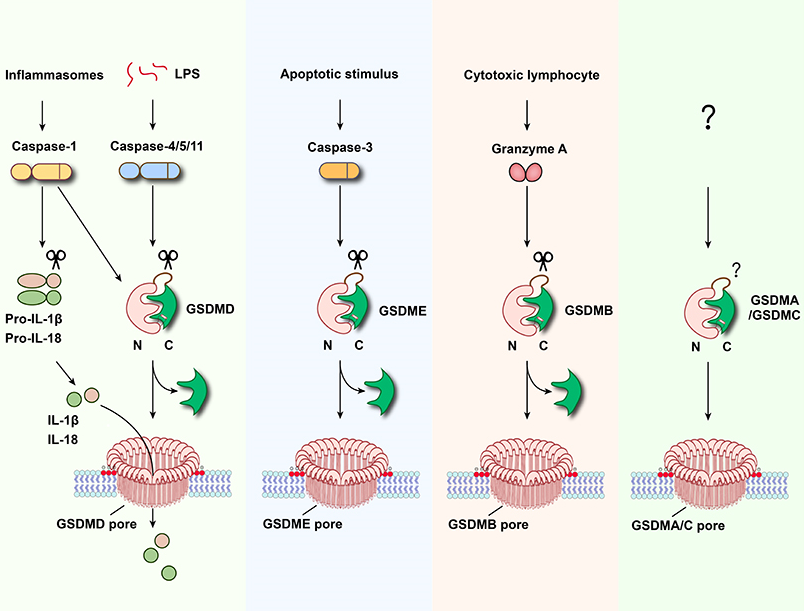
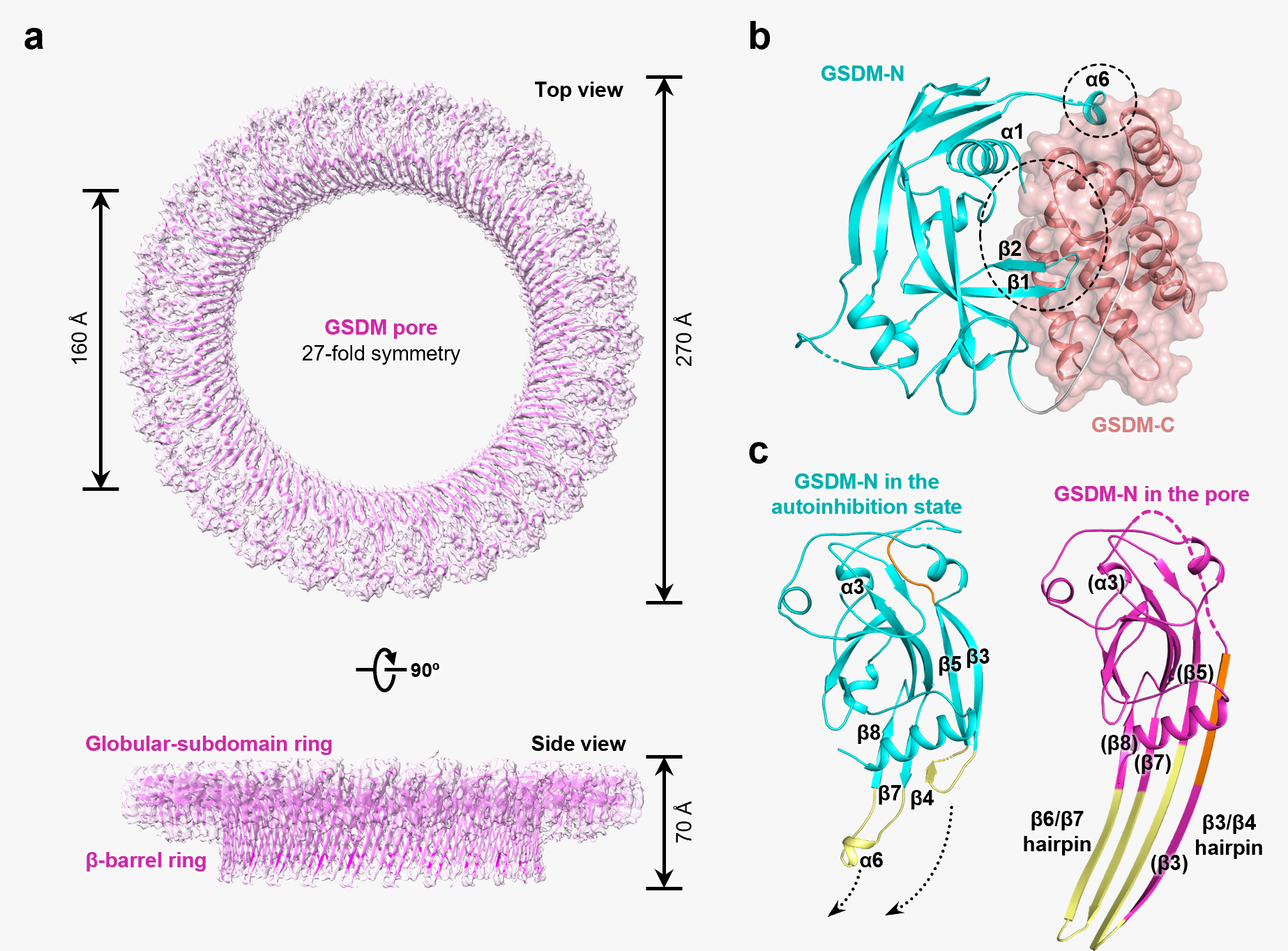
细胞焦亡是一种最近发现的细胞程序性死亡方式,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。自2015年以来,邵峰院士研究团队发现,caspase-1和caspase-11/4/5是通过切割一个叫做GSDMD的蛋白而诱发细胞焦亡的。GSDMD在被caspase-1或caspase-11/4/5切割后,释放出其N端结构域,该结构域具有结合膜磷脂并在细胞膜上打孔的活性,从而导致细胞渗透压的变化而发生胀大,直至细胞膜的最终破裂(Shi et al., Nature 2015;Ding et al., Nature 2016),并释放包括IL-1β在内的多种促炎性细胞因子。
细胞焦亡是机体重要先天免疫反应,在拮抗感染和内源危险信号中发挥重要作用。细胞焦亡广泛参与感染性疾病、神经系统相关疾病、动脉粥样硬化等炎症性疾病的发生发展,对细胞焦亡的深入研究有助于认识其在相关疾病发生和转归中的作用,为临床防治提供新思路。
由于炎症小体异常激活在炎症性疾病的关键作用,炎症小体通路的关键蛋白尤其是NLRP3已经成为相关药物研发的一大热点,而炎症小体下游细胞焦亡执行蛋白GSDMD则是该领域一个更理想的药物研发靶点。
Gasdermin家族蛋白包含GSDMA, GSDMB, GSDMC, GSDMD, GSDME和PJVK六个成员。2015年邵峰院士研究团队里程碑式的工作首次揭示了GSDMD是细胞焦亡(Pyroptosis)的执行者,并且发现该家族成员(PJVK除外)的N端结构域均具有膜打孔活性诱导细胞焦亡的功能(Shi et al., Nature 2015, Ding et al., Nature 2016)。研究表明,Gasdermin 家族蛋白(包括GSDMA, GSDMB, GSDMC, GSDMD和GSDME)在脓毒症、多发性硬化症、哮喘、化疗药物导致的炎性损伤、病毒感染或者CAR-T治疗引起的细胞因子风暴以及IBD肠炎等多种炎症性疾病中发挥关键作用。因此,开发特异性的Gasdermin抑制剂将会为这些临床未满足的需求提供全新的解决方案。
更令人鼓舞的是,邵峰院士研究团队发现通过诱导少部分肿瘤细胞发生细胞焦亡,能够显著地改变肿瘤免疫微环境,将“冷肿瘤”变为“热肿瘤”,使肿瘤细胞增强对肿瘤免疫药物(如anti-PD-1)的响应。




 京公网安备 11011402014160号
京公网安备 11011402014160号
